行業(yè)動態(tài)
一致性評價LOGO好處多大?首批品種逐個算
作者: 來源: 日期:2018-01-04 10:54:11
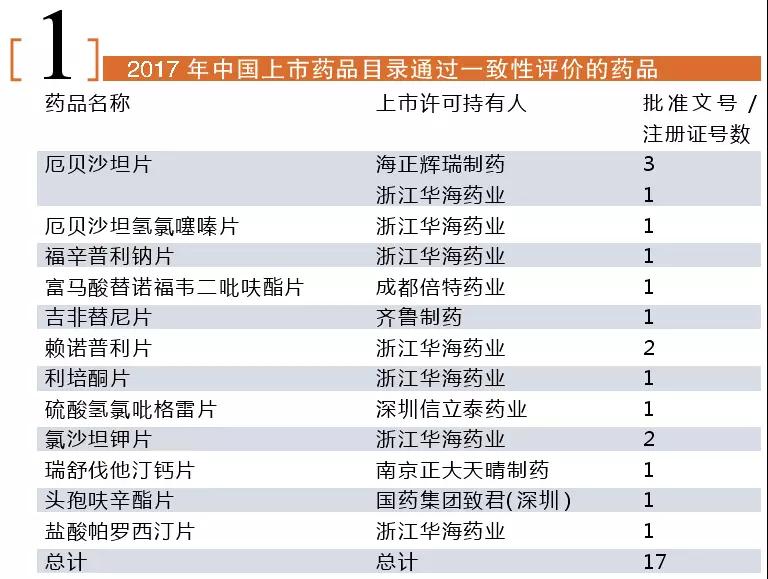
CFDA在2017年12月29日發(fā)布符合仿制藥質量和療效一致性評價要求的藥品申請品種目錄。當日,中國上市藥品目錄集上線亦公布了已公布通過質量和療效一致性評價的產品共17個批文。
通過一致性評價,對企業(yè)而言究竟意味著多大的利好呢?為此,筆者對首批通過一致性評價的品種的醫(yī)院銷售情況、市場份額分布情況以及申報一致性評價的廠家情況進行綜合分析。
筆者預計,2018年,將有越來越多企業(yè)獲批通過一致性評價,長期利好項目質量高和提前布局國際化的企業(yè)。
總覽
七家藥企獲年終紅包
首批通過一致性評價的藥品上市許可持有人暫無中小企業(yè)和研發(fā)機構。華海藥業(yè)共7個產品9個生產批號獲批通過一致性評價,是首批通過一致性評價的生產廠家中最大的贏家。成都倍特藥業(yè)、國藥集團致君(深圳)制藥、海正輝瑞制藥、南京正大天晴制藥、齊魯制藥和深圳信立泰藥業(yè)各有1個產品獲批通過一致性評價。
首批通過一致性評價的產品中,頭孢呋辛酯片、硫酸氫氯吡格雷片、利培酮片和鹽酸帕羅西汀片都是289目錄的品種。
獲批時間3~6個月
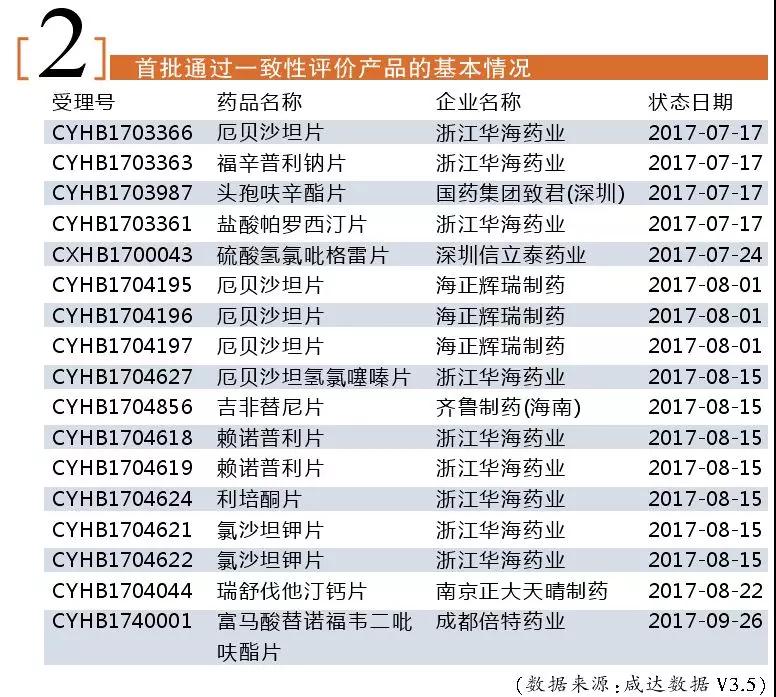
2015年公布要以企業(yè)為主導通過一致性評價,從2017年7月起CFDA開始接收企業(yè)的一致性評價申請,至2017年12月29日第一批獲批。因此,通過一致性評價的獲批時間在3個月~6個月范圍內。
此外,中國上市藥品目錄集還公布了進口原研藥批文172個,創(chuàng)新藥批文11個,其它藥品批文1個,按化學藥品新注冊分類批準的仿制藥批文2個。
點評
華海憑借“雙報”首批7個產品獲批一致性評價。同樣是“雙報”產品較多的恒瑞、石藥暫未在第一批名單中出現,這與它們目前申報產品數相對較少有關。
變局
厄貝沙坦片
樣本醫(yī)院金額:3.7億元
厄貝沙坦片是唯一的兩個生產廠家過一致性評價的產品。兩家中,浙江華海僅拿到1個規(guī)格(75mg),海正輝瑞拿到3個規(guī)格(75mg、150mg、300mg),目前樣本醫(yī)院市場賣得最好的是150mg,預計海正輝瑞在此產品中獲益最大。
厄貝沙坦片一直是專利過期原研藥占據77%以上市場份額的產品。海正輝瑞和浙江華海在樣本醫(yī)院市場的占比都沒超過1%。預計獲批通過一致性評價后,主要爭奪原研廠家的市場份額,其次就是國內廠家份額前五的江蘇恒瑞醫(yī)藥、珠海潤都制藥、揚子江藥業(yè)集團北京海燕藥業(yè)、華潤雙鶴利民藥業(yè)(濟南)和石家莊以嶺藥業(yè)。不過,目前除了已經獲批的兩家企業(yè),并未有其他企業(yè)申報一致性評價。
厄貝沙坦氫氯噻嗪片
樣本醫(yī)院金額:2.3億元
厄貝沙坦氫氯噻嗪片目前共有2家申報(南京正大天晴和浙江華海),但首批通過一致性評價的只有浙江華海。
厄貝沙坦氫氯噻嗪片也是專利過期原研藥銷售額占比超過50%的產品。華海所占份額約為4%,排名大致在國內企業(yè)第三名。華海獲批通過一致性評價后,原研藥企賽諾菲將要面臨同質量層次競價,南京正大天晴、內蒙古元和則要加快一致性評價的步伐。
福辛普利鈉片
樣本醫(yī)院金額:0.5億元
福辛普利鈉目前只有原研和華海在銷,原研藥占86%的市場規(guī)模。華海獲批通過一致性評價后,能否奪取更多市場份額,有待時間證明。目前尚無其他廠家申報一致性評價。
富馬酸替諾福韋二吡呋酯片
樣本醫(yī)院金額:1.3億元
富馬酸替諾福韋二吡呋酯的仿制藥自2016年起就有不少生產廠家獲批,2016年主要銷售的還是進口產品。
2017年申報一致性評價的暫時有成都倍特和齊魯制藥。成都倍特首先通過一致性評價,預計短期內能爭奪不少外企的市場份額。
值得注意的是,后來廠家也會努力通過一致性評價,如正大天晴,雖然目前尚未有其他申報一致性評價的企業(yè)。
吉非替尼片:
樣本醫(yī)院金額:2.8億元
吉非替尼片2016年在銷的主要也是原研藥,2016年齊魯制藥獲批首仿,2017年齊魯制藥又率先通過該品種的一致性評價。目前齊魯制藥在搶奪專利過期原研藥的市場,未來能搶到多少,主要取決于原研藥的降價幅度以及齊魯制藥的銷售能力。
目前尚無申報一致性評價的其他廠家。對于吉非替尼片的仿制藥廠家來說,想要獲得生產批準文號,就要爭取在這三年上市并獲批通過一致性評價了。
賴諾普利片
樣本醫(yī)院金額:265萬元
華海藥業(yè)以27%的份額成為賴諾普利片市場占比最多的廠家,緊跟華海之后的還有上海信誼、國藥集團汕頭金石等。
本次獲批通過一致性評價后,華海藥業(yè)有望搶奪別的生產廠家的市場,鞏固排頭兵的位置。目前尚無申報一致性評價的其他廠家。
利培酮片
樣本醫(yī)院金額:1.5億元
目前進口原研藥占據利培酮片近七成的醫(yī)院用藥份額,浙江華海藥業(yè)以7%的份額排名國內企業(yè)第三。目前尚無申報一致性評價的其他廠家。預計西安楊森、江蘇恩華、齊魯制藥將要面臨來自華海的挑戰(zhàn)。
硫酸氫氯吡格雷片
樣本醫(yī)院金額:23.4億元
自神經內科輔助用藥被限制使用后,氯吡格雷的業(yè)績增長較為明顯。2016年始終是原研藥占據五成以上的市場份額,信立泰占了31%的份額。
信立泰獲批通過一致性評價后,競爭壓力最大的預計是原研藥,因為同在一個質量層次。
另一方面,目前尚無申報一致性評價的其他廠家。沒有通過一致性評價的其它廠家,會因醫(yī)療機構優(yōu)先使用通過一致性評價產品而銷售下滑。
氯沙坦鉀片
樣本醫(yī)院金額:3.5億元
默沙東占了73%的市場份額,揚子江排名第二占17%,浙江華海占7%排名第三。目前尚無申報一致性評價的其他廠家。
值得注意的是,上海諾華也在做臨床。預計未來一致性評價大軍中,會出現進口仿制藥大軍。
瑞舒伐他汀鈣片
樣本醫(yī)院金額:10.3億元
原研生產廠家占69%市場份額,南京正大天晴以7%排名國內企業(yè)第三。瑞舒伐他汀鈣片2017年申報一致性評價的有浙江京新藥業(yè)和南京正大天晴,浙江京新是2017年7月最早申報一致性評價的,現在要面臨發(fā)補充批件延遲。
南京正大天晴獲批通過一致性評價后,壓力較大的是IPR、魯南貝特制藥和浙江京新藥業(yè)。
頭孢呋辛酯片
樣本醫(yī)院金額:1.1億元
頭孢呋辛口服藥排名第一的是蘇州中化,占據41%;GSK的原研產品占22%;國藥集團致君占21%。頭孢呋辛目前在銷的近半數生產廠家在2017年啟動了BE臨床,如蘇州中化、珠海聯(lián)邦制藥中山分公司、成都倍特藥業(yè)、石家莊四藥、華北制藥河北華民藥業(yè)、國藥集團汕頭金石制藥和石藥集團歐意藥業(yè)。
國藥集團致君首個獲批通過頭孢呋辛的一致性評價。首個獲得一致性評價的產品能否有領頭羊效應,頭孢呋辛口服藥2018年也許會有新的成功案例可以參照。
鹽酸帕羅西汀片
樣本醫(yī)院金額:2.2億元
排名第一的中美天津史克制藥占45%,華海緊跟其后排43%。首獲通過一致性評價的華海藥業(yè),能不能搶到中美天津史克的市場份額,要看招標的降價幅度。暫時可見的競爭對手是北京萬生藥業(yè),其在2017年12月BE備案啟動臨床。