行業動態
代理之殤!2016新批藥品數量稀缺
作者: 來源: 日期:2016-11-14 10:21:16
為了解決藥品注冊審評審批積壓問題,2015年和2016年CFDA發布了連串的藥品注冊法規,政策導向下工業藥品注冊申報大幅度減少,并且藥品獲批越來越難。代理商陷入找不到新產品的困境。
▌2016年市場新產品稀缺
2016年,代理商們都在煩惱一個共性問題:新產品太少了。好不容易國內廠家批了一個新產品,但是一看獲批的廠家,傳統直營制的廠家,獲得代理權無望,能夠代理運作的新產品實在太少了。即使是代理制的生產廠家獲批新品,在新產品稀缺的背景下,新產品的代理條件水漲船高,只有較高經濟實力的代理商能夠搶得代理權。
CFDA的2016年都批了些什么藥?
大量的原料藥(46%)和注射劑(44%)——大多都不需要臨床核查。
2016年CFDA公布的獲批藥品清單中,屬于新藥的制劑只有6個,其中2個是中藥,3個生物制品中有2個是疫苗。中藥面臨醫院入藥難的困境,疫苗由于山東疫苗事件后渠道和營銷的難度加大。
對于企業而言,沒有新產品沒有新鮮的血液增長難以延續。
對于代理商和銷售團隊而言,沒有新產品且舊產品市場集中度提高意味著商業/工作機會的減少。
新產品稀缺背景下,2016年藥交會預計代理商會面臨選擇困境。代理商只能翻來覆去地尋找舊批文信息,渴望找一個長期沒有銷售突然恢復生產的批文,或者在獨家中藥中尋找機遇。
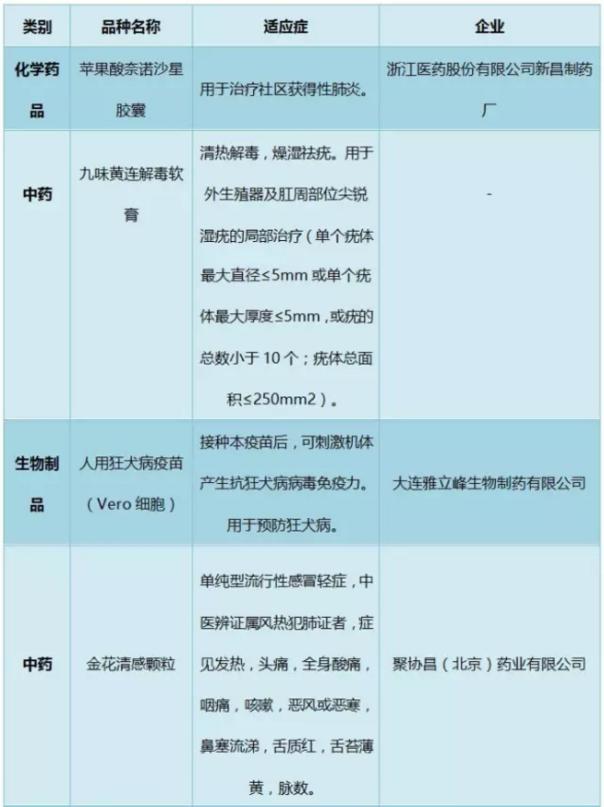
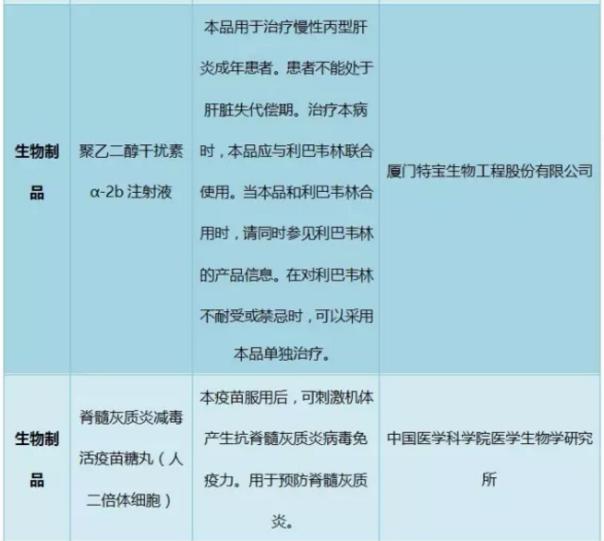
2016年獲批新藥制劑
之所以2016年新藥產品稀缺,與2015年和2016年CFDA發布了連串的藥品注冊改革政策有關。
▌回顧:大量積壓推動藥政注冊改革
2015年7月以前,業界一直抱怨CFDA特別是CDE的注冊審批審評審批速度太慢,一些老百姓急需的新藥難以快速投入市場,既阻礙了新藥研發,也跟不上老百姓的用藥需求。根據排隊審批的速度估算,2015年新報的仿制舊6類藥的申報最快也要8年才能注冊成功。
審評審批積壓排隊制讓首家獲批的生產廠家獲得時間優勢——第二家獲批的可能要半年,甚至2年才得有可能排隊成功獲得審批。于是,各藥品生產企業拼命搶報首仿,搶仿的速度有些據說能迅速到美國首次上市后不到三個月在我國申報就能拿上首仿申報的受理號。臨床批件的溢價也催生了CRO的產業鏈,一個首仿藥臨床批件的報價最高峰時高達千萬級別。
2015年7月29日,國務院第二次大督查提出藥品審評審批效率有待提高。7月31日CFDA以《國家食品藥品監督管理總局關于征求加快解決藥品注冊申請積壓問題的若干政策意見的公告(2015年第140號)》回應,開始了一連串藥品注冊政策改革的序幕。
▌CFDA解決注冊申請積壓是一套組合拳
CFDA需要解決積壓,套路有二:一是想方設法減少企業申報量;二是共性問題快做結論批量解決。CFDA用了一套組合拳解決此問題。
第一拳叫臨床試驗自查核查,1622個受理號嚇跑了1193個受理號。臨床試驗自查核查將成為常態,以后藥品都要接受臨床核查了。2016年公布了4批臨床自查核查,最后一批自查核查數據中摻雜了79%的外企驗證性臨床試驗申報的國際多中心臨床試驗數據,內企需要臨床核查的新藥從第一批的948個,到第二批的33個,到第三批的10個,到第四批的1個,呈現懸崖式的下降。仿制藥的需要接受臨床核查的也同樣如此,從第一批的503個,直線下降到第二批的13個。
第二拳是一致性評價。公告2015年第140號前所未有地將一致性評價放到一個至高無上的位置——仿制藥按與原研藥質量和療效一致的原則受理和審評審批。這一拳意味著之前申報的藥品注冊,99.9%都要返工重做資料。從中國食品藥品檢定研究院所公布的企業參比制劑備案情況可知,申請備案的企業不到450家,而國內的化學藥制劑生產企業遠遠高于此數量,這意味著化學藥制劑生產廠家有可能壓縮到500家以內。
第三拳是政策慢慢發。新的注冊管理辦法重新修訂需要時間,在法規未明朗,但是法規將“加劇優勝劣汰,藥品研發的成本大幅度提高”是確切的。企業在執行法規沒明確之前不敢隨便申報注冊。在新注冊辦法沒發布之前,2016年的仿制藥月新注冊量下降到個位數,相對于2014年也是大幅度下降?;瘜W藥政策主要改革的是仿制藥和改良型藥,對于1類新藥的影響有限,2016年的申報注冊新藥的申報維持在一個穩定水平。截止至2016年11月10日仿制藥相關的注冊法規2016年還在發布中。
第四拳是臨床批件批量發批量斃,只要產品沒有新藥監測期保護都會批批批,若產品在新藥監測期內其它廠家的注冊申請都是斃斃斃。
第五拳是加快審評審批制度,CDE公布了一連串的目錄,但是相比于一般注冊的產品,究竟加快了多少,從來都沒有官方數據。
第六拳是公布了重復申報較為重災區的產品清單,CFDA認為一個通用名10個生產廠家絕對能應付目前的市場需求。那對于已經重復申報的產品究竟是批還是不批,一切都有可能。
第七拳是CDE號稱加人了。
七拳下來,企業已經不敢隨便申報,大家也都忙活一致性評價了。藥品注冊申報量大幅度下降,臨床批件批量發出,藥企也不敢隨意開項目做,積壓有望解決了。CFDA每個月還經常有能解決臨床需求的新藥獲批的信息公布。